在新冠疫情之前,藥品開發很少用「迅速」一詞進行描述。常見的原因包括候選藥品數量衆多、且損耗率高。另一個不可否認的因素是,用來衡量藥品有效性和安全性的監管程式,不得不依賴於一系列漫長的研究與試驗的結果。
Cytiva 的銷售、服務和商業運營高級副總裁 Amanda Halford 表示:「一個新產品推向市場通常需要 10 年,這是行業基準。」疫情改變了這個狀況。疫苗開發速度如此之快,她解釋道,部分原因是公共衛生面臨的緊迫風險,促使監管者基於通常的審批標準,採取同時而非依次審查結果的方式,從而加快審批速度。
藥品開發呈現良好勢頭
許多國家和地區都加快了藥品開發的速度。在 2020 年末和 2021 年初, Cytiva 進行的全球生物製藥彈性指數調查發現,70% 的受訪者用「好」或「非常好」來評價本國藥品審批機構的速度。
大多數藥品審批機構並沒有制定新法規,而是基於已有許可權臨時批准了藥品。有些機構運用了簡單直接的法規。例如,新加坡衛生科學局設立了大流行病特別通道(Pandemic Special Access Route),用於在大流行中授權新的干預措施。在一些其他地方,政府擴展了已有法規的應用範圍。過去,美國食品暨藥物管理局(FDA)、歐洲藥品管理局(EMA)和英國藥品與保健品管理局(MHRA)的疫苗緊急和臨時授權規則,通常只適用於非常有限的情況,例如罕見病藥品。
然而,許多國家和地區沒有這些可以再利用的法規。國際疫苗研究所總幹事 Jerome Kim 表示:「在疫情早期,監管機構在診斷、再利用藥物和疫苗方面承受了巨大壓力。而各國爭相快速且系統地審查申請,則可能引發審查倉促或不完整的質疑。"
將疫情期間的經驗付諸實踐
對於監管的未來,疫情期間的工作提供了兩個經驗。首先,在確保安全性的情況下,加快監管決策速度和藥品獲取速度是可行的。其次,就何時以及如何實行這樣的監管,公衆希望出臺明確的規定。
大多數生物製藥公司高階主管希望,這種加快監管行動的勢頭可以得到保持。最近, Cytiva 對全球500 名生物製藥高階主管進行了一項調研,60% 的受訪者預計,未來兩年,藥品審批速度將會加快,而只有 19% 的人認爲可能會放緩。51% 的受訪者表示,政府的更多參與,加快了新藥的上市速度,持相反觀點的人只佔25% 。
生物製藥公司高階主管預計,藥品審批將會加快
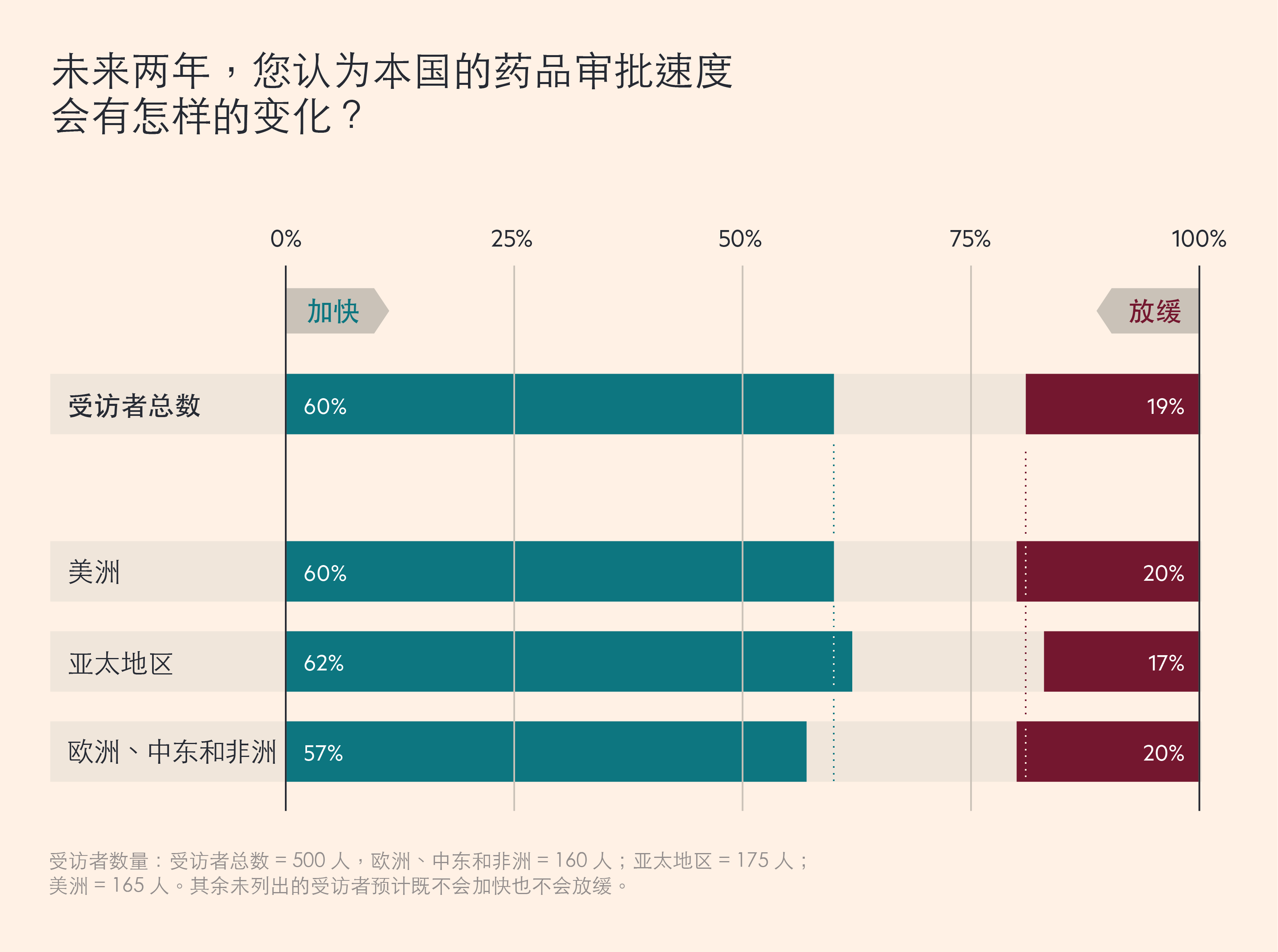
受訪者數量:受訪者總數 = 500 人,歐洲、中東和非洲 = 160 人;亞太地區 = 175 人;美洲 = 165 人。其餘未列出的受訪者預計既不會加快也不會放緩。
這些數字意味著,不同的司法管轄區內,變化速度亦有不同。例如,在歐洲,63% 的英國受訪者認爲,當前的政府幹預正在加快藥品上市速度,但在德國,這一比例僅爲 43%。
協作加速審批進程
加速審批,並不代表在評估安全性和有效性時走捷徑。相反,其目的是減少不必要的延誤。
以阿布扎比爲例,政府對一項新臨牀試驗所需的步驟進行了深入研究,進而將一個長達數月的過程縮短爲8 到 15 天。這些新規將使當地試驗的開展,變得更加容易。
更爲重要的是,臨牀研究者和監管機構改進了共享資訊的方式。Jerome Kim 回憶說,隨著監管機構開始允許分批提交臨牀實驗數據, 「疫情期間的學習曲線」 出現了。「美國食品暨藥物管理局實行了這一舉措,」他表示,"其他國家和地區也採用了類似的機制。"
這是疫情期間更廣泛的資訊共享的一部分。Amanda Halford 解釋說,雖然新冠疫情之前,監管機構與臨牀研究者的聯繫已然存在,「但疫情的確加速了這種溝通。你能看到聯繫變得更爲頻繁。」她指出,這始於疫苗開發方面的合作,例如美國的「神速行動」(Operation Warp Speed)計劃和英國疫苗小組(UK Vaccine Taskforce)等創新舉措。這些合作後來擴展到了疫苗價值鏈的其他地方,「然後進入到供應鏈問題的分支領域,例如規模與製造,」 Halford 補充說。
約半數生物製藥公司高階主管認同,政府參與加快了新藥的上市速度

受訪者數量:受訪者總數 = 500 人,歐洲、中東和非洲 = 160 人;亞太地區 = 175 人;美洲 = 165 人。其餘未列出的受訪者既沒有看到消極影響,也沒有看到積極影響。
這種廣泛互動改善了政府與生物製藥行業的長期關係。FUJI FILM Diosynth Biotechnologies 首席執行長 Martin Meeson 表示:「當下政府與整個行業溝通、合作的方式與水準,讓我對未來充滿期待。」與此同時,他認爲,現在的挑戰是如何在未來五年保持這一勢頭。
政府參與的增加,正在改變生物製藥發展戰略
受訪者數量:受訪者總數 = 500 人,歐洲、中東和非洲 = 160 人;亞太地區 = 175 人;美洲 = 165 人
隨著合作關係的加深,廣泛的數據共享使智慧財產變得更爲重要。在這方面,52% 的受訪者認爲,政府的參與產生了積極影響,而只有 27% 的人認爲影響是消極的。
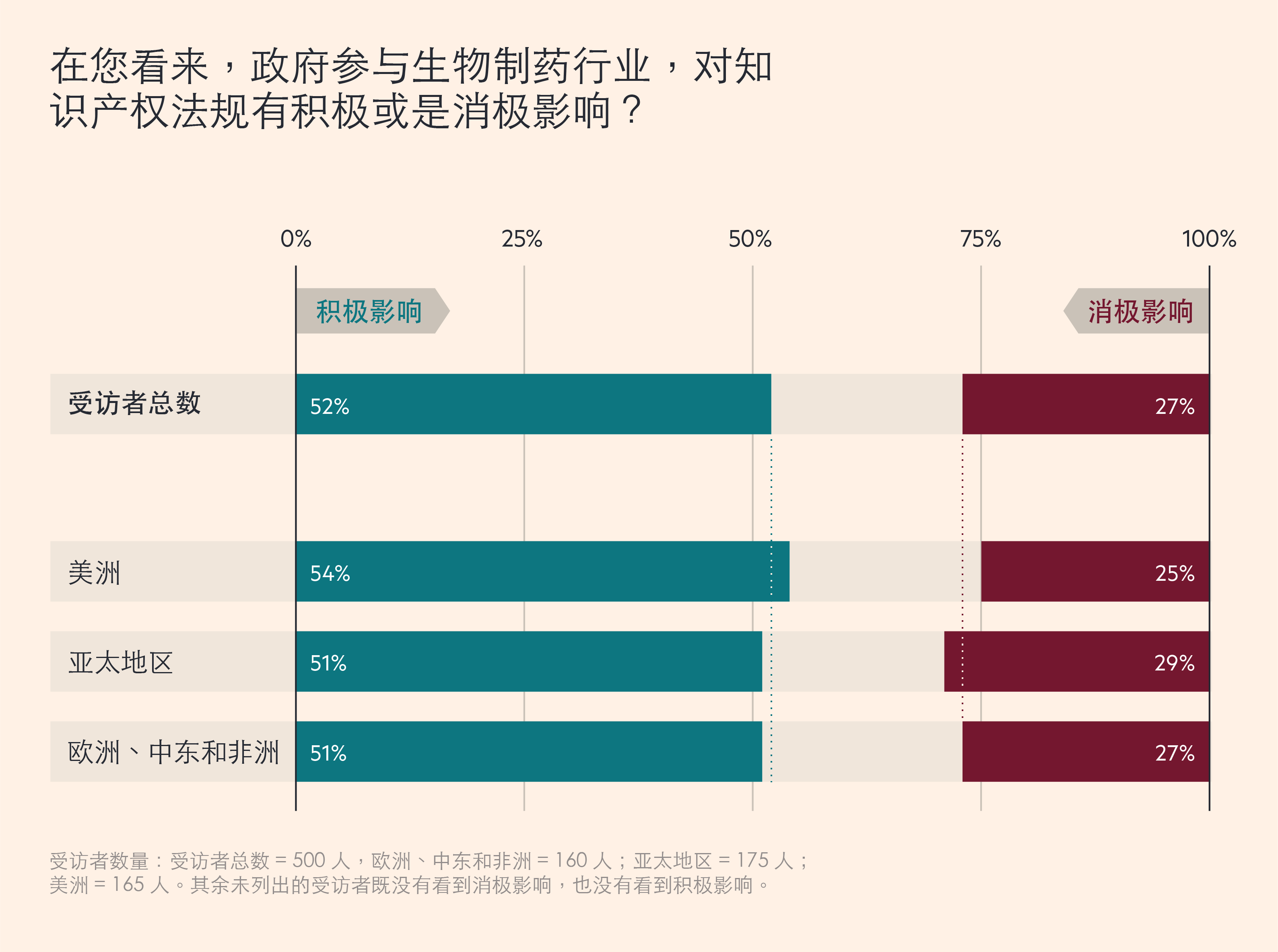
受訪者數量:受訪者總數 = 500 人,歐洲、中東和非洲 = 160 人;亞太地區 = 175 人;美洲 = 165 人。其餘未列出的受訪者既沒有看到消極影響,也沒有看到積極影響。
然而,仔細觀察不難發現,在不同國家和地區,政府參與對智慧財產的影響也不盡相同。例如,印度在新冠疫情達到頂峯時,停止了疫苗的出口,當地只有 46% 的受訪者認爲,政府幹預對智慧財產產生了積極影響,而 36% 的受訪者表示,這種影響是消極的。而中國在疫情期間,不斷尋求擴大全球疫苗市場,則有58%的受訪者認同積極影響,僅 18%的人認同消極影響。
清晰、健全的智慧財產保護法規絕不僅是錦上添花。在 Halford 看來, 這是「整個(藥品開發)過程所需框架的重要組成部分。」如果缺失保護法規,投資可能性會不可避免地降低,而這將減緩新療法的開發與獲取速度。
基於監管的必要性,現在各國可以更進一步
賦予藥品審批規則新的靈活性、推動監管行動的新速度,是政府和製藥公司擴展合作的一部分。54% 的受訪者表示,他們的高階主管正在與政府領導或代表進行更密切的合作。只有 15% 的人持相反意見。
合作的方式多種多樣。它可以像南韓 20 億美元的 K 疫苗計劃一樣,透過大量投資,增強本土的綜合研發與製造能力。
而在一些其他地方,僅僅依靠疫情期間的監管進步,就可能會產生顯著效果。海灣國家就是例證。在新冠疫情之前,當地缺乏強大的製藥研發或製造基地。不過,這些國家樹立了一個簡單的政策目標:面對疫情,成爲最快批准並獲得新的醫療干預措施的一批國家。爲了實現這個目標,就必須對研發、智慧財產和藥品審批方面的法規進行徹底改革。結果不言自明——它們成爲了全球第一批審查、許可、推出疫苗和後續治療的國家。
即使在疫情沒有帶來重大監管變革的地方,專家們也感受到了監管進步的必要性。例如,中國醫藥企業管理協會會長郭雲沛表示,中國的「制度還在不斷完善,我們必須要簡化藥品審批流程,與世界接軌。」
國家和地區的發展水準不同,走出的道路也各具特色,但每個地方都可以在疫情中汲取一般經驗並受益。「如何發揚在疫情期間形成的積極工作方式,並將其用於其他療法的開發,政府和行業都感到了肩頭的責任,」Meeson 補充道,「我們積累了很多寶貴的知識,現在我們需要把它付諸實踐。」



